Daftar isi
KINETIKA REAKSI DEKOMPOSISI H2O2
I. Latar belakang
Reaksi hidrogen peroksida dengan kalium iodida dalam suasana asam (dan dengan adanya natrium tiosulfat) akan membebaskan iodida yang berasal dari kalium iodida. Kecepatan reaksi ini sangat tergantung kepada peroksida, kalium, iodida dan asamnya. Bila reaksi ini merupakan reaksi irreversible (karena adanya natrium tiosulfat) yang akan berubah iodium bebas menjadi asam iodida kembali, kecepatan reaksi yang terjadi besarnya seperti pada pembentukannya, sampai konsentrasi terakhir tak berubah.
Kinetika kimia menjelaskan bagaimana laju reaksi bergantung pada konsentrasi reaktan dan mengetahui mekanisme suatu reaksi yang diperoleh dari suatu eksperimen. Kecepatan reaksi bergantung pada banyak faktor. Konsentrasi reaktan memainkan peran penting dalam mempercepat atau memperlambat reaksi tertentu. Sebagaimana akan banyak reaksi yang sangat peka terhadap suhu, sehingga pengendalian suhu sangat penting untuk pengukuran kuantitatif dalam kinetika kimia. Akhirnya, bentuk fisik reaktan juga berperan penting dalam laju yang diamati. Sebuah paku besi sangat lambat teroksidasi menjadi besi oksida di udara kering, tetapi serat baja mudah sekali terbakar terutama karena adanya oksigen. Kajian kuantitatif atas reaksi heterogen (yang melibatkan dua fasa atau lebih, seperti antara solid dan gas) memang sulit, sehingga kita mulai dengan reaksi homogen (yang seluruhnya berlangsung dalam fasa gas atau larutan). Karena kaitannya begitu erat dengan kejadian sehari-hari maka dilakukanlah percobaan ini agar mengetahui penerapannya dalam kehidupan sehari-hari.
II. Tujuan Percobaan
- Untuk menentukan harga-harga konstanta kecepatan reaksi dekomposisi H2O2 dengan katalis FeCl3 pada suhu tertentu (T1 dan T2)
- Untuk menentukan energi aktivasi reaksi dekomposisi H2O2
III. Dasar Teori
Reaksi kimia adalah proses berubahnya pereaksi menjadi hasil reaksi. Proses itu ada yang lambat dan ada yang cepat. Contohnya bensin terbakar lebih cepat dibandingkan dengan minyak tanah. Ada reaksi yang berlangsung cepat, seperti membakar dinamit yang menghasilkan ledakan, dan yang sangat lambat adalah proses berkaratnya besi. Pembahasan tentang kecepatan (laju reaksi) disebut kinetika kimia. Dalam kinetika kimia ini dikemukakan dengan cara menentukan laju reaksi dan faktor apa yang mempengaruhinya (Syukri, 1999).
Kinetika reaksi esterifikasi dapat ditentukan berdasarkan teori pseudo-homogen, yaitu dengan asumsi tidak adanya difusi intra-partikel. Kecepatan pengadukan yang cukup tinggi mampu mengatasi tahanan difusi. Umumnya reaksi padat-cair dimodelkan dengan menggunakan pendekatan heterogen atau pseudo-homogen. Reaksi transesterifikasi dengan katalis padat dapat didekati dengan model reaksi pseudo-homogen, karena tahanan perpindahan massa eksternal dan difusi internal katalis dapat diabaikan (Nugrahani dkk, 2013).
Saponifikasi merupakan proses hidrolisis basa terhadap lemak dan minyak, dan reaksi saponifikasi bukan merupakan reaksi kesetimbangan. Hasil mula-mula dari penyabunan adalah karboksilat karena campurannya bersifat basa. Setelah campuran diasamkan, karboksilat berubah menjadi asam karboksilat (Naomi dkk, 2013).
Dalam reaksi unimolekuler, hanya ada satu reaksi yang terlibat dalam perubahan kimia. Contoh dari reaksi ini adalah disosiasi bromin pada suhu tinggi, penataan ulang dari asam maleat pada saat pemanasan, dan disintegrasi radioaktif. Dalam reaksi biomolekul dan molekul yang harus terbentuk koloid sebelum terjadinya reaksi. Molekularitas reaksi didefinisikan sebagai jumlah molekul reaktan yang harus bersama-sama sebelum terjadinya reaksi. Dari pertimbangan dalam stabilitas kimia farmasi harus relevan untuk mengetahui urutan reaksi yang diperoleh secara eksperimental dengan mengukur laju reaksi sebagai fungsi dari konsentrasi obat yang rendah (Parrot, 1970).
Tujuan dari mempelajari laju reaksi adalah untuk dapat memprediksi laju suatu reaksi. Hal tersebut dapat dilakukan dengan hitungan matematis melalui hukum laju, sebagai contoh pada reaksi:
dimana A dan B adalah pereaksi, C dan D adalah produk sedangkan a, b, c, d adalah koefisien penyetaraan reaksi, maka hukum lajunya dapat dituliskan sebagai berikut menurut Keenan (1984):
dengan:
k = tetapan laju, dipengaruhi suhu dan katalis(jika ada)
m = orde(tingkat) reaksi terhadap pereaksi A
n = orde(tingkat) reaksi terhadap pereaksi B
[A][B] = konsentrasi dalam molaritas
Umumnya hidrogen peroksida digunakan dengan memanfaatkan dan merekayasa reaksi dekomposisinya, yang intinya menghasilkan oksigen. Pada tahap produksi hidrogen peroksida, bahan stabilizer kimia biasanya ditambahkan dengan maksud untuk menghambat laju de komposisinya. Termasuk dekomposisi yang terjadi selama produk hidrogen peroksida dalam penyimpanan. Selain menghasilkan oksigen, reaksi dekomposisi hidrogen peroksida juga menghasilkan air (H2O) dan panas. Reaksi dekomposisi eksotermis yang terjadi adalah sebagai berikut:
Keunggulan hidrogen peroksida dibandingkan dengan oksidator yang lain adalah sifatnya yang ramah lingkungan karena tidak meninggalkan residu yang berbahaya. Kekuatan oksidatornya pun dapat diatur sesuai dengan kebutuhan. Sebagai contoh dalam industri pulp dan kertas, penggunaan hidrogen peroksida biasanya dikombinasikan dengan NaOH atau soda api. Semakin basa, maka laju dekomposisi hidrogen peroksida pun makin tinggi (Atkins, 1989).
Dalam sistem tertutup, laju reaksi kimia didefinisikan secara sederhana sebagai laju perubahan konsentrasi reaktan dan produk dalam satuan waktu. Konsentrasi diberikan dalam jumlah unit tertentu tiap satuan volume (Triyono, 1998).
Langkah yang menentukan kinetika reaksi adalah gabungan perpindahan massa dan reaksi kimia. Menetapkan reaksi kimia merupakan langkah yang menentukan. Hal ini disebabkan pengadukan menggunakan pengaduk mekanis sehingga tahanan perpindahan massa dapat dianggap tidak ada atau diabaikan (Sulistyo dkk, 2010).
Orde reaksi berkaitan dengan pangkat dalam hukum laju reaksi, reaksi yang berlangsung dengan konstan, tidak tergantung pada konsentrasi pereaksi disebut orde reaksi nol. Reaksi orde pertama lebih sering menampakkan konsentrasi tunggal dalam hukum laju dan konsentrasi tersebut berpangkat satu. Rumusan yang paling umum dari hukum laju reaksi orde dua adalah konsentrasi tunggal berpangkat dua atau dua konsentrasi masing-masing berpangkat satu. Salah satu metode penentuan orde reaksi memerlukan pengukuran laju reaksi awal dari sederet percobaan. Metode kedua membutuhkan pemetaan yang tepat dari fungsi konsentrasi pereaksi terhadap waktu. Untuk mendapatkan grafik garis lurus (Bird, 1993).
IV. Hipotesis
- Harga dari kecepatan reaksi dekomposisi H2O2 dengan katalis FeCl3 pada suhu tertentu (T1 dan T2). Pada saat suhu T1 (suhu rendah) akan memiliki kecepatan reaksi yang lebih lambat dari pada saat T2 (suhu tinggi) karena pada kisaran suhu 20–100°C kenaikkan temperatur akan mengakibatkan laju reaksi semakin cepat
- Pada percobaan dekomposisi H2O2 dengan katalis FeCl3 kemungkinan yang terjadi adalah terjadinya reaksi antara H2O2 dengan katalis FeCl3 yang akan menghasilkan O2, sehingga volume aquades akan menjadi turun. Ketika katalis ditambahkan pada H2O2 maka akan terjadi perubahan pada laju reaksi yang semakin menjadi cepat, sehingga perubahan laju reaksi ini dapat digunakan untuk menentukan energi aktivasi.
V. Metodologi Percobaan
5.1 Alat dan Bahan
- Tabung reaksi (2 buah)
- Selang berkaret penutup 75 cm (1 buah)
- Selang kecil 75 cm (1 buah)
- Buret (1 buah)
- Stopwatch digital (1 buah)
- Gelas ukur (1 buah)
- Corong kaca (1 buah)
- Bunsen (1 buah)
- Termometer (1 buah)
- Penjepit kayu (1 buah)
- Statif (1 buah)
- H2O2 0,4 M (10 ml)
- FeCl3 0,005 M (5 ml)
- Aquades (10 ml)
- Batu didih (3 buah)
- Metilen biru (3 tetes)
- Potongan kentang mentah (0,5 × 0,5 × 0,5) cm (3 buah)
5.2 Gambar Alat
VI. Prosedur Kerja
6.1 Biokatalis pada dekomposisi H2O2
10 ml aquades dimasukkan ke dalam tabung reaksi dan diberi 3 tetes metilen biru. Pada tabung reaksi satunya diberi 20 ml H2O2 dan diberi potongan kentang 3 buah. Kedua tabung reaksi dihubungkan dengan selang berpenutup karet, bagian sambungannya ditutup dengan aluminium foil agar udara tidak keluar dari tabung. Reaksi diamati hingga 30 menit dan dicatat perubahannya.
6.2 Dekomposisi dengan katalis
Alat percobaan dirangkai seperti Gambar 1. Aquades dimasukkan ke dalam buret dan diatur ketinggiannya agar sama antara buret besar dengan buret kecil. 20 ml H2O2 dicampur dengan 10 ml FeCl3 dan 3 batu didih. Campuran dimasukkan ke dalam tabung reaksi. Tabung reaksi dihubungkan dengan buret menggunakan selang berkaret setiap 1 menit dihitung perubahan volume buret yang terjadi (volume O2 yang terbentuk). Percobaan dilakukan 10 kali (ketika tabung reaksi dilepas dan selang buret ditutup). Suhu awal dihitung (T1). Percobaan tadi diulang dengan tabung reaksi yang dipanaskan hingga T2 (suhu tertentu). Dijaga agar T2 tetap pada tiap percobaan dan pencatatan data percobaan (10 kali).
Pada Gambar 2 dibuat grafik hubungan antara H2O2 versus t (menit) dan Gambar 3 dibuat grafik hubungan antara -log [H2O2] versus t (menit) pada T1. Setelah grafik dibuat, harga k ditentukan, kolom-kolom lembar data percobaan diisi untuk k1 atau dengan cara dihitung (lihat lampiran). Untuk T2 Gambar 4, grafik hubungan antara H2O2 versus t (menit) dan Gambar 5, grafik hubungan antara -log [H2O2] versus t (menit) dibuat dan nilai k2 ditentukan. Gambar 6 grafik hubungan antara ln k versus 1/T dibuat dengan data k1 dan k2 serta T1 dan T2. Energi aktivasi (Ea) ditentukan.
VII. Data dan Analisa
7.1 Data Percobaan
7.2 Analisa Data
Pada percobaan biokatalis pada dekomposisi H2O2 didapatkan adanya gelembung-gelembung. Gelembung ini menunjukkan aktifnya enzim katalase yang terdapat pada ekstrak yang telah dibuat. Enzim katalase ini dapat menguraikan senyawa hidrogen peroksida H2O2 yang tidak baik bagi tubuh menjadi air dan oksigen yang sama sekali tidak berbahaya bagi tubuh. Pada menit ke 4 gelembung awal mulai muncul dan semakin banyak sampai menit ke 8. Menit ke 10 sampai menit ke 14 aquades dengan metilen biru berubah warna menjadi biru pekat akibat dari aktivitas enzim katalase. Reaksi tersebut membuat kentang menjadi mengembang pada menit ke 60 dan akhirnya reaksi berhenti (gelembung tidak terlihat lagi).
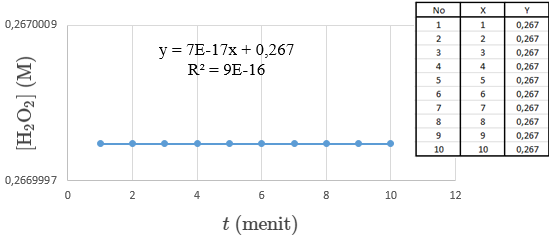
Pada percobaan dekomposisi H2O2 dengan katalis FeCl3 tanpa pemanas didapatkan data yang sama dari menit ke 1 sampai menit ke 10 dan tidak terjadi perubahan warna yaitu warnanya tetap orange muda. Sehingga bentuk grafik yang didapatkan adalah seperti gambar di bawah ini:
kedua grafik diatas menunjukkan bahwa selama percobaan tidak terjadi apa-apa, ini disebabkan karena kesalahan-kesalahan yang dilakukan selama praktikum seperti tidak memahami prosedur percobaan, salah menghitung, dan lain-lain. Dari percobaan dekomposisi H2O2 dengan katalis FeCl3 tanpa pemanas dihasilkan data yang sama rata pada percobaan menit ke 1 sampai ke 10, yaitu volume gas O2 sebesar 0 ml, H2O2 yang bereaksi 0 mmol, H2O2 yang tersisa sebanyak 4 mmol, [H2O2] sebesar 0,267 mmol/ml dan -log [H2O2] sebesar 0,573. Pada nilai r (laju reaksi) didapatkan nilai sebesar 0 M/s dan nilai k1 sebesar 1.
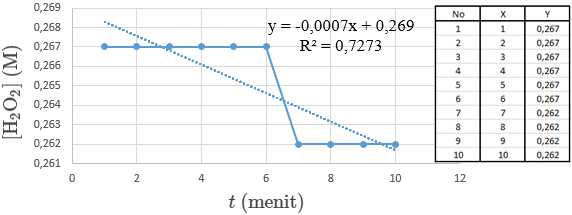
Percobaan selanjutnya adalah dekomposisi H2O2 dengan katalis FeCl3 dengan pemanas (75°C) didapatkan percobaan volume di buret sebesar 1 ml (10 ke 9), dengan tanpa adanya perubahan warna. Berikut ini adalah grafiknya:
pada kedua grafik diatas didapatkan grafik yang agak berbeda dengan kedua grafik sebelumnya, mungkin hal ini karena reaksi dipanaskan sehingga terjadi perubahan volume akibat penguapan. Uap yang terdapat pada buret menaikkan volume air di buret yang lain, sehingga terjadi perubahan volume. Dari grafik diatas didapatkan H2O2 bereaksi, gas O2, volume gas O2 sebesar nol pada menit 1 sampai ke 6. H2O2 sisa sebesar 4 mmol pada menit ke 1 sampai ke 6 dan 3,936 mmol pada menit ke 7 sampai ke 10. H2O2 sebesar 0,0267 mmol/ml pada menit ke 1 sampai ke 6 dan 0,262 mmol/ml pada menit ke 7 sampai ke 10. -log [H2O2] sebesar 0,573 mmol/ml pada menit ke 1 sampai ke 6 dan 0,581 mmol/ml pada menit ke 7 sampai ke 10. Didapatkan nilai dari k2 sebesar 0,999963.
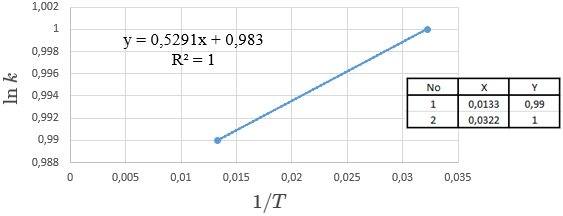
Hasil dari nilai k1 dan k2 di atas dapat langsung diplot ke dalam grafik sehingga dapat menentukan energi aktivasinya. Berikut adalah grafiknya:
dari data grafik hubungan antara ln k dengan 1/T didapatkan nilai energi aktivasi sebesar 0,0907 J. Gambar 2 sudah jelas menunjukkan besarnya energi aktivasi dari kedua percobaan dari sebelum dipanaskan dan setelah dipanaskan. Hal ini juga menunjukkan kebenaran dari hipotesis awal, bahwa pada suhu rendah kecepatan reaksi menjadi lebih lambat daripada suhu tinggi karena kenaikkan temperatur mengakibatkan laju reaksi semakin cepat. Hipotesis ke 2 juga terbukti benar bahwa reaksi antara H2O2 dengan katalis FeCl3 menghasilkan O2, yang mengakibatkan volume aquades menjadi menurun. Penambahan katalis pada H2O2 mengakibatkan perubahan pada laju reaksi yang menjadi semakin cepat, sehingga perubahan laju reaksi ini dapat digunakan untuk menentukan energi aktivasi.
VIII. Kesimpulan
- Nilai dari konstanta kecepatan reaksi dekomposisi H2O2 dengan katalis FeCl3:
- Suhu 31°C dan k1= 1
- Suhu 75°C dan k2= 0,99963
- Energi aktivasi pada reaksi dekomposisi H2O2 sebesar 0,0907 J
IX. Daftar Pustaka
- Atkins, P., 1989. Kimia Fisika. Jakarta: Erlangga.
- Bird, T., 1993. Kimia Fisika Untuk Universitas. Bandung: ITB.
- Keenan, C.W., 1984. Kimia Untuk Universitas Jilid I. Jakarta: Erlangga.
- Naomi, P., Gaol, A.M.L. and Toha, M.Y., 2013. Pembuatan Sabun Lunak dari Minyak Goreng Bekas ditinjau dari Kinetika Reaksi Kimia. Jurnal Teknik Kimia, 19(2), p.44.
- Nugrahani, R., Firdaus, F.E. dan Widyawati, Y., 2013. Kinetika Reaksi Hidroksilasi Epoksi Minyak Jarak Pagar Menggunakan Katalis Bentonit. Jurnal Teknik Kimia, 11(5), p.258.
- Parrot, E.L., 1970. Teknologi Farmasi. Jakarta: Erlangga.
- Sulistyo, H., Fadjri, M. dan Nuryoto, 2010. Kinetika Reaksi Oksidasi Katalitik Fero Sulfat dari Limbah Besi dalam Reaktor Luluhan. Reaktor, 13(2), p.71.
- Syukri, S., 1999. Kimia Dasar. Jakarta: Gramedia Pustaka Utama.
- Triyono, T., 1998. Buku Ajar Kinetika Kimia. Yogyakarta: UGM.

![Grafik hubungan -log [H_2O_2]-t sebelum dipanaskan Grafik hubungan -log [H_2O_2]-t sebelum dipanaskan](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEjSnAKHrkWq66MpL317NtZodZjEktnprkYNajKbY0_Cm5Dlj76FKoogqTDIoqCSwOkFUx0SW1bh0haDX5vwYqhvgSctmv7HkO4F9JaWsR4sT-7XUSmq5YrCVBvnGmC2ia5s7SnSHn3tF_762hv29MryZqwL_9Fve9_MnlV1jnb9Xmuz8R4Up_fo9c2zig/s1600/1.png)
![Grafik hubungan -log [H_2O_2]-t pada suhu pemanasan 75°C Grafik hubungan -log [H_2O_2]-t pada suhu pemanasan 75°C](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgG3jxgIWznVYDcZ30VgfZO8vygUELkutUdutjFdWRFY6xseh6mFEi15YieHRUx-Vg3-GEon1wYafafJdt19_ZG9Tjsqt_PyOocQCpM-JRSlN_DH44SOu_hCGHa3J2KzzhGsVvhl-Tuyy65zrH3_9b3h2ki27MjHoi9v-GdpG4EC2TILJEff0oFa_Wvcw/s1600/1.png)