Daftar isi
TERMOKIMIA
I. Latar belakang
Perubahan suhu, sebagaimana dijelaskan dalam banyak literatur ilmu kimia dasar adalah salah satu ciri yang menentukan keberlangsungan reaksi kimia yang sedang diamati. Perubahan suhu pada suatu reaksi kimia juga dapat dijelaskan dengan hukum-hukum termodinamika, dimana terdapat hubungan antara suhu yang berubah dengan penyerapan dan pelepasan kalor pada reaksi kimia tersebut. Sedangkan bidang ilmu kimia yang menerapkan hukum-hukum termodinamika adalah termokimia.
Menurut ilmu termodinamika pula, diketahui bahwa suatu reaksi kimia dapat berlangsung secara spontan apabila reaksi tersebut mempunyai banyak energi bebas, dan memiliki kecenderungan untuk melepaskan energi yang dikandungnya untuk mencapai kestabilan energi (eksergonik). Dengan demikian, energi yang dilepaskan dari reaksi tersebut dapat menaikkan suhu lingkungan disekitar sistem (dengan kata lain bersifat eksotermik), dan menurunkan suhu sistem itu sendiri. Sementara itu, hal ini jelas berkebalikan apabila dilihat dari reaksi endergonik yang tidak akan berlangsung apabila energi yang diserap dari lingkungan tidak cukup untuk memulai reaksi. Energi yang diserap ini akan menurunkan suhu lingkungan disekitar sistem (bersifat endotermik), dan menaikkan suhu sistem itu sendiri.
Setiap reaksi kimia selalu diikuti dengan perubahan energi, perubahan energi pada reaksi kimia dapat dipelajari dengan metode kolorimetri. Maka dari itu dilakukanlah percobaan ini untuk mempelajari lebih dalam bahwa setiap reaksi kimia selalu disertai dengan perubahan energi melalui metode kolorimetri.
II. Tujuan Percobaan
- Untuk mempelajari bahwa setiap reaksi kimia selalu disertai dengan perubahan energi
- Untuk mempelajari bahwa perubahan kalor dapat diukur atau dipelajari dengan percobaan yang sederhana
III. Dasar Teori
Termodinamika adalah suatu cabang ilmu yang mempelajari perubahan energi secara kimia atau fisis. Dalam percobaan ini, kita akan menyelidiki perubahan energi dalam bentuk kalor, yang mengiring reaksi kimia (termokimia). Menurut hukum termodinamika, perubahan energi yang menyertai perubahan wujud dinyatakan dalam persamaan:
dengan Q adalah kalor yang diserap oleh sistem, W = kerja yang dilakukan oleh sistem. Kebanyakan reaksi kimia berlangsung pada tekanan tetap, kerja dirumuskan dengan persamaan:
dengan P adalah tekanan pegas, ΔV adalah perubahan volume untuk sistem gas oleh karena pada tekanan tetap.
bila ΔV = 0, maka ΔE = Q. Kuantitas kalor yang diserap pada tekanan tetap disebut entalpi (ΔH) (Epinur, 2011).
Biomassa dapat dikonversi menjadi berbagai jenis bahan bakar dan produk dengan proses konversi termokimia. Proses tersebut dapat dibagi menjadi tiga, yaitu: gasifikasi, pirolisis, dan pencairan secara termokimia. Untuk mengolah limbah biomassa yang biasanya memiliki kadar air relatif tinggi, metode pirolisis dan gasifikasi membutuhkan energi tambahan untuk menguapkan air yang terkandung, sehingga total efisiensi energinya menjadi rendah. Pada proses gasifikasi dan pirolisis sebagian besar produk cair yang berupa minyak juga ikut terdegradasi. Metode pencairan secara termokimia tidak membutuhkan energi tambahan untuk menguapkan air yang terkandung dalam biomassa, karena produk akhirnya sebagian besar pada fase cair baik yang berupa larutan dalam air maupun berupa minyak yang tidak larut dalam air. Minyak cair yang dihasilkan melalui metode ini cukup banyak dibandingkan pirolisis dan gasifikasi (Sembodo dan Jumari, 2008).
Dekomposisi tongkol jagung dalam etanol panas bertekanan pada suhu superkritik dengan katalis natrium karbonat dapat menghasilkan produk berupa minyak, arang, dan gas. Suhu pemanasan dan konsentrasi solven yang menghasilkan jumlah minyak terbanyak diperoleh pada 260°C dan 15% (Santoso dan Sembodo, 2015).
Hukum Hess menyatakan bahwa 'Entalpi suatu reaksi tidak dipengaruhi oleh jalannya reaksi akan tetapi hanya bergantung pada keadaan akhir'. Artinya untuk menentukan entalpi suatu reaksi tunggal maka kita bisa mengkombinasikan berbagai reaksi sebagai jalan untuk menentukan entalpi reaksi tunggal tersebut (Oxtoby, 2001).
Kalorimeter didasarkan kenaikan suhu yang teramat dalam beberapa medium. Kalor spesifik dari zat adalah banyaknya kalor yang dibutuhkan untuk menaikkan suhu dari 1 gram zat pada 1°C. Besaran lain yang berhubungan adalah kapasitas kalor yang merupakan banyaknya kalor yang dibutuhkan untuk menaikkan suhu suatu zat bermassa pada 1°C. Banyaknya kalor yang keluar maupun masuk dari zat adalah:
ΔT adalah perubahan suhu yang diperoleh dari tf- ti dimana tf merupakan final temperature dan ti adalah initial temperature
sehingga persamaan kalor spesifik:
dimana m merupakan massa gram dari zat yang menyerap kalor dan C = mc (Chang, 1995).
Dengan menggunakan lambang ∑ yang berarti 'jumlah semua' atau 'penjumlahan dari', para ahli kimia secara sembarang telah mendefinisikan perubahan entalpi (ΔH), suatu reaksi sebagai:
apabila entalpi pereaksi lebih besar daripada entalpi produk, maka reaksi itu adalah endotermik. Sebaliknya, jika entalpi produk lebih besar daripada entalpi pereaksi, maka reaksi itu endoterm (Keenan, 1980).
Kalorimeter adalah suatu alat yang digunakan untuk mengukur perubahan kalor. Salah satu jenis kalorimeter adalah kalorimeter bom. Sistem termodinamika adalah isi dari kalorimeter tersebut, antara lain: reaktan dan produk bom itu sendiri, air tempat bom termometer, dan pengaduk merupakan lingkungannya (Petrucci, 1992).
IV. Hipotesis
- Pada reaksi CuSO4 dan bubuk Zn maupun reaksi penetralan HCl dan NaOH akan menghasilkan perubahan kalor sebagai tanda adanya energi yang diserap atau dilepas. Zn akan bereaksi dengan CuSO4 membentuk ZnSO4 dan Cu, dan HCl akan bereaksi dengan NaOH membentuk NaCl dan H2O.
- Penentuan tetapan kalorimeter dengan aquades merupakan reaksi sederhana yang akan dapat membuktikan adanya kalor.
V. Metodologi Percobaan
5.1 Alat dan Bahan
- Kalorimeter (1 buah)
- Termometer (1 buah)
- Pengaduk (1 buah)
- Stopwatch digital (1 buah)
- Gelas beker (1 buah)
- Gelas ukur (1 buah)
- Corong kaca (1 buah)
- Kompor listrik (1 buah)
- Aluminium foil (secukupnya)
- Aquades (50 ml)
- CuSO4 1 M (25 ml)
- HCl 1 M (25 ml)
- NaOH 1 M (25 ml)
- Bubuk Zn (1,5 gram)
5.2 Gambar Alat
VI. Prosedur Kerja
6.1 Penentuan tetapan kalorimeter
Aquades 25 ml dimasukkan ke dalam kalorimeter dan temperaturnya dicatat. 25 ml aquades dipanaskan dalam gelas beker ± 10°C diatas temperatur kamar 36°C dan catat temperaturnya. Kemudian aquades panas dicampurkan ke dalam aquades dingin dalam kalorimeter, diaduk, diamati temperaturnya selama 10 menit dengan selang 1 menit setelah pencampuran, di atas penutup kalorimeter ditutup aluminium foil. Kurva pengamatan temperatur dengan selang waktu dibuat untuk menentukan harga penurunan air panas dengan menaikkan temperatur air dingin.
6.2 Penentuan kalor reaksi Zn(s) + CuSO4(aq)
25 ml larutan CuSO4 1 M dimasukkan dalam kalorimeter dan temperatur dicatat. Bubuk Zn ditimbang sebesar 1,5 gram dan dimasukkan dalam larutan CuSO4 di kalorimeter. Temperatur dicatat selama 1 menit setelah pencampuran 10 menit. Kenaikkan temperatur diukur menggunakan grafik.
6.3 Penentuan kalor penetralan HCl dan NaOH
25 ml HCl 1 M dimasukkan dalam kalorimeter dan temperatur dicatat, 25 ml NaOH 1 M dicampur ke dalam kalorimeter dan temperatur campuran dicatat selama 5 menit dengan selang 0,5 menit, grafik dibuat untuk memperoleh perubahan temperatur akibat reaksi tersebut, entalpi penetralan dihitung.
VII. Data dan Analisa
7.1 Data Percobaan
7.2 Analisa Data
Prinsip pada percobaan ini adalah dengan cara mencampurkan kedua zat yang mempunyai perbedaan suhu dalam kalorimeter, zat yang mempunyai suhu tinggi akan melepaskan kalor dari zat yang mempunyai suhu rendah akan menerima kalor yang dilepaskan sehingga suhu akhir atau campuran dapat ditentukan. Kemudian salah satu variabel yang belum diketahui seperti kalor jenis, kapasitas bahan kalor, massa, dan kalor dapat ditentukan melalui persamaan. Proses dalam kalorimeter berlangsung secara adiabatik, yaitu tidak ada energi yang lepas atau masuk dari luar ke dalam kalorimeter.
Kalorimeter yang baik adalah kalorimeter yang medium dalamnya terbuat dari kaca mengkilap menyerupai cermin. Cermin tersebut bertujuan agar tidak terjadi perpindahan kalor secara radiasi dari larutan ke medium. Pada percobaan ini digunakan kalorimeter gabus yang bertujuan agar panas tidak dapat diserap oleh gabus dan tidak pergi keluar lingkungan.
Tetapan kalorimeter yang didapat dalam percobaan ini adalah sebesar 117,5 J/°C dengan penerimaan kalor sebesar 838,125 J dari reaksi air panas dan air dingin. Terjadi 2 macam reaksi saat air panas dan air dingin tersebut dicampurkan, kedua reaksi tersebut adalah reaksi endoterm dan reaksi eksoterm. Reaksi eksoterm terjadi ketika air panas yang suhunya lebih tinggi melepaskan kalor. Kalor yang dilepaskan oleh air panas kemudian diterima oleh air dingin, saat itulah reaksi endoterm berlangsung.
Melalui metode grafik dapat dilihat data hasil pencampuran air panas dan air dingin selama 10 menit dengan selang 1 menit, berikut gambar grafiknya:
suhu pada menit ke 1 adalah 31,5°C dan pada menit ke 2 sampai menit ke 10 suhu berada pada titik 31°C. Seharusnya suhu tetap konstan pada saat menit awal sampai menit akhir pencampuran karena sistem tersebut terisolasi, kemungkinan terjadi kesalahan pada saat percobaan, yaitu pada menit awal suhu sebelum tercampur merata sehingga pada menit selanjutnya suhu turun, tutup kalorimeter belum tertutup sempurna, kurang teliti dalam mengukur volume air, dan kurang teliti saat mengukur suhu air. Penentuan kalor reaksi CuSO4 dan Zn menghasilkan reaksi ZnSO4 + Cu
Entalpi reaksi (ΔHR) pada reaksi antara CuSO4 dan Zn adalah sebesar +377.889,25 J/mol. Pada reaksinya, kedua zat yang direaksikan tersebut menghasilkan endapan ZnSO4 yang berwarna kecoklatan.
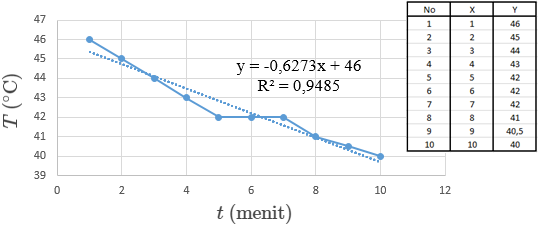
Metode grafik penentuan kalor reaksi Zn + CuSO4 dapat dilihat pada gambar grafik di bawah ini:
pada menit ke 1 sampai menit ke 5 terjadi pemanasan suhu dari 46°C ke 42°C. Selanjutnya suhu pada menit ke 5 sampai menit ke 7 tetap berada pada suhu 42°C, kemudian turun kembali sampai menit ke 10. Dapat disimpulkan grafik tersebut mengalami penurunan suhu akibat terjadinya reaksi secara endoterm atau penyerapan energi pada reaksi tersebut.
Jika dilihat pada perubahan suhu yang terjadi dan juga dari ΔHR yang dihasilkan, dapat disimpulkan bahwa reaksi antara Zn(s) dan CuSO4(aq) berlangsung secara endoterm. Adanya penurunan suhu menunjukkan bahwa adanya kalor yang diserap pada reaksi tersebut. Sementara jika dilihat dari entalpi reaksi (ΔHR) yang dihasilkan yang bernilai positif maka semakin memperkuat hasil yang didapat bahwa reaksi berlangsung secara endoterm.
Percobaan terakhir adalah penentuan kalor penetralan HCl dan NaOH. NaOH jika direaksikan dengan HCl akan menghasilkan NaCl dan air.
Entalpi penetralan (ΔHR) antara larutan NaOH dan HCl yang didapat berdasarkan percobaan adalah 0 J/mol. Hal ini terjadi karena suhu tidak berubah sampai menit ke 10. Hasil ini ditunjukkan oleh gambar grafik di bawah:
suhu pada reaksi tersebut tetap berada pada titik 34°C dari menit ke 0,5 sampai menit ke 10. Hal ini menunjukkan bahwa tidak terjadi reaksi secara eksoterm maupun endoterm pada reaksi NaOH dan HCl karena suhu awal dan akhirnya bernilai sama yaitu sebesar 34°C. Hal ini tidak sesuai dengan hipotesis dan juga seharusnya pada reaksi kimia selalu disertai dengan perubahan energi, kemungkinan ada kesalahan-kesalahan selama percobaan, yaitu adanya energi yang terserap ke lingkungan, tutup kalorimeter belum tertutup sempurna, kurang teliti dalam mengukur volume HCl atau NaOH, dan kurang teliti saat melihat termometer.
VIII. Kesimpulan
- Reaksi dari CuSO4 dan bubuk Zn menunjukkan adanya perubahan kalor sebagai tanda adanya energi yang diserap atau dilepas tetapi tidak dengan reaksi penetralan HCl dan NaOH. Reaksi HCl dan NaOH tidak mengalami perubahan kalor karena kesalahan-kesalahan yang dilakukan saat percobaan.
ΔHR: Zn + CuSO4 = +377.889,25 J/mol
ΔHR: HCl + NaOH = 0 J/mol - Pada reaksi penentuan tetapan kalorimeter dengan aquades dapat dibuktikan adanya suatu kalor melalui reaksi yang sederhana melalui aquades dingin dan panas dalam kalorimeter gabus. Pada percobaan ini didapatkan tetapan kalorimeter sebesar k = 1117,5 J/°C
IX. Daftar Pustaka
- Epinur, Y., 2011. Penuntun Praktikum Kimia Dasar. Jambi: Universitas Jambi.
- Keenan, C.W., 1980. Kimia Untuk Universitas Edisi 6. Jakarta: Erlangga.
- Oxtoby, D.W., 2001. Prinsip-Prinsip Kimia Modern Edisi 4 Jilid I. Jakarta: Erlangga.
- Petrucci, R.H., 1992. Kimia Dasar Edisi 4 Jilid I. Jakarta: Erlangga.
- Santoso, E. dan Sembodo, F., 2015. Pencarian Tongkol Jagung Secara Termokimia dalam Etanol Superkritik. Jurnal Equilibrium, 14(1), p.11.
- Sembodo, B. dan Jumari, A., 2008. Dekomposisi Jerami Secara Termokimia dalam Air Panas Bertekanan. Jurnal Equilibrium, 7(1), pp.1-2.